El virus que come bacterias
Aunque parezca contraintuitivo, el descubrimiento de los fagos como un arma contra las bacterias patógenas precede al descubrimiento de la penicilina. El microbiólogo francés Felix d’Herelle descubrió un “antagonista invisible” que era capaz de aniquilar a las bacterias. Al principio lo llamó así porque era un organismo tan pequeño que atravesaba los filtros desarrollados por Chamberland y Pasteur para eliminar bacterias de sus muestras de agua. Sin embargo, d’Herelle pronto se dio cuenta de que estaba ante un nuevo tipo de virus, que bautizó como “bacteriófago”, literalmente el virus “comebacterias”. Más adelante, d’Herelle llevó a cabo varios experimentos que, entre otras cosas, demostraron que los fagos podían infectar y matar a las bacterias que causan el cólera, la disentería y la peste. D’Herelle utilizó fagos para tratar con éxito infecciones bacterianas en humanos, un avance revolucionario en ese momento. Sin embargo, a pesar de este éxito inicial, los científicos occidentales dejaron de prestar atención a los fagos, asombrados por las aplicaciones y la versatilidad de la penicilina como antibiótico.
La investigación de fagos continuó en la antigua Unión Soviética gracias a George Eliava, un colega y colaborador de d’Herelle que fundó un instituto de investigación en la actual Georgia. Aunque Eliava fue ejecutado en 1937 por el régimen totalitario de Joseph Stalin, el apoyo soviético a la investigación permitió que continuara el desarrollo de fagos terapéuticos. Era parte del sistema estándar de atención médica en la Unión Soviética. Dependiendo del tipo de infección, los sanitarios decidían si utilizar fagos, antibióticos o una combinación de ambos métodos, cuenta la doctora rusa Mzia Kutateladze en una entrevista a la BBC. Durante mucho tiempo, esta terapia se consideraba prácticamente una pseudociencia en occidente, en parte por las implicaciones políticas de la Guerra Fría, pero también por la falta de acceso a las publicaciones sobre el tema, a menudo difíciles de encontrar y solo disponibles en ruso. Tras muchos años en la sombra, los fagos se volvieron famosos de nuevo a finales de los 1990 y principios de los 2000, cuando científicos del instituto georgiano fundado por Eliava consiguieron curar a un paciente canadiense de una infección causada por una bacteria resistente. Estos resultados tan positivos, combinados con la creciente preocupación sobre el aumento de las infecciones causadas por bacterias resistentes a los antibióticos, renovaron el interés en los fagos.
Desde entonces, ha habido un resurgimiento significativo en la investigación y el desarrollo de terapias basadas en fagos. En los últimos años, se han logrado avances significativos en la comprensión de la biología de los fagos y en el desarrollo de técnicas para utilizarlos como agentes antimicrobianos. Actualmente se conocen miles de tipos diferentes de fagos, específicos para aniquilar a diferentes tipos de bacterias y otros microbios. Esta diversidad ofrece un ejemplo del amplio espectro de posibilidades terapéuticas para combatir una variedad de infecciones bacterianas.
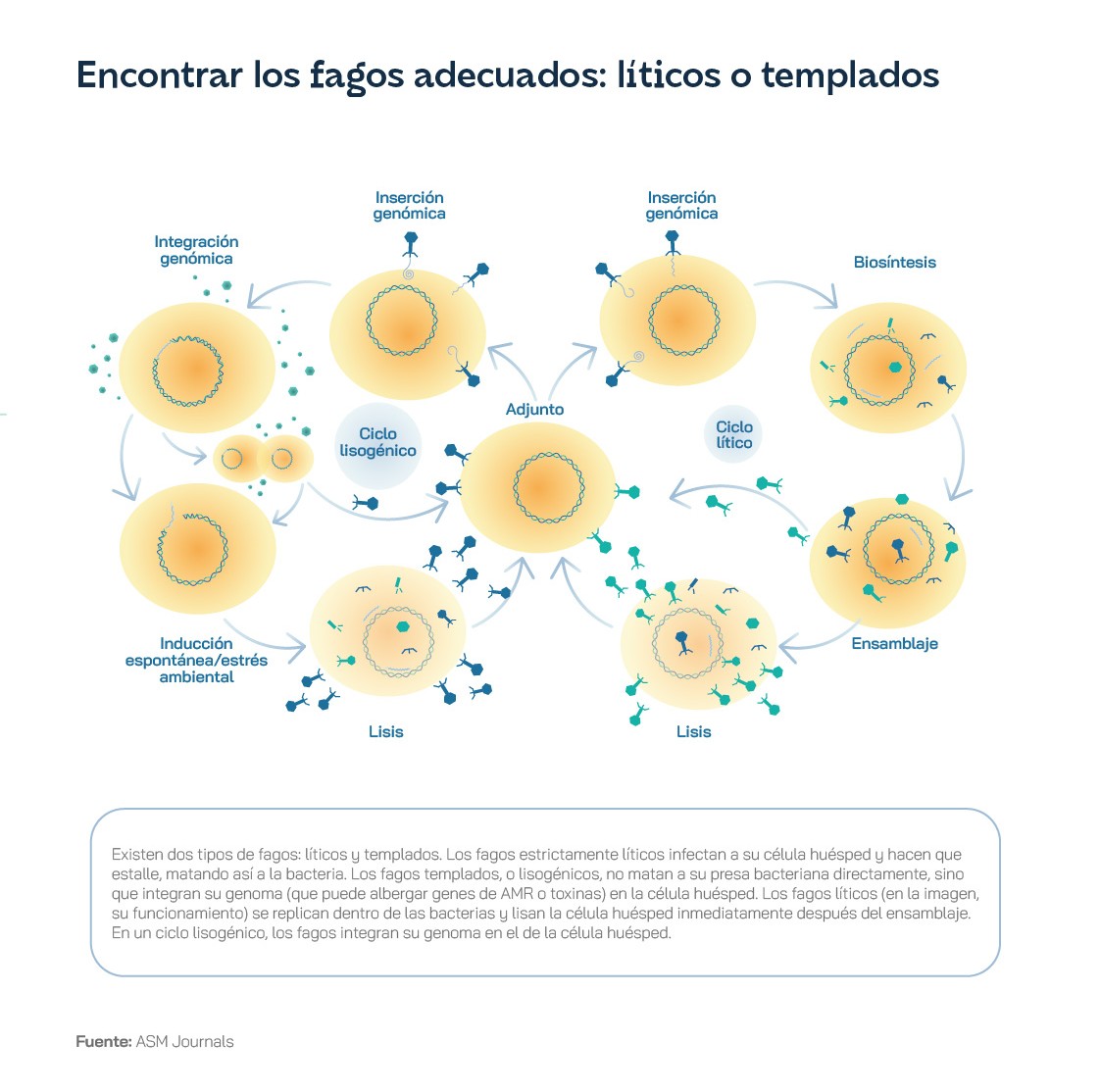
Los antibióticos como la penicilina –y todos los medicamentos desarrollados después– son sustancias químicas, más o menos complejas, que interactúan con algunos de los procesos bioquímicos de las bacterias, interrumpiendo su viabilidad. Sin embargo, los fagos son virus, estructuras mucho más avanzadas, capaces de parasitar y aniquilar a las bacterias. Como entidades biológicas, tienen relaciones complejas y coevolutivas con ellas. Los fagos presentan dos tipos distintos de ciclos vitales: el ciclo lítico y el ciclo lisogénico. En el primero, el fago se adhiere a la membrana bacteriana e inyecta su material genético dentro de la bacteria. El virus se aprovechará de la maquinaria celular de la bacteria, incluidas sus proteínas y enzimas, para generar copias de sí mismo y, después, ensamblarlas, formando nuevos fagos – normalmente entre 50 y 200. Una vez el ejército de descendientes está listo, se provoca la ruptura –o lisis, de ahí el nombre del ciclo– de la bacteria y se liberan los fagos al medio, listos para propagar la infección y adherirse a nuevas bacterias para comenzar el ciclo nuevamente. En el ciclo lisogénico, los fagos insertan su material genético en el ADN de la bacteria, lo que otorga a la bacteria inmunidad contra infecciones sucesivas. Cuando la bacteria se reproduzca, hará una copia de su ADN y, con ello, copias del ADN del fago, que permanece latente hasta que se den las condiciones para “activarse” y empezar un proceso de infección.
En el contexto de los usos terapéuticos, los fagos que pueden realizar ciclos líticos suelen ser los más relevantes. En este sentido, por lo tanto, es necesario aislar y caracterizar fagos que puedan ser específicos y selectivos contra las bacterias responsables de infecciones peligrosas, para poder amplificarlos y administrarlos de una forma segura, pero que permita que entren en contacto directo con el patógeno. Por ejemplo, en una infección osteoarticular como la que tenía el paciente canadiense tratado en Georgia, se recomienda lavar la herida con una solución de fagos antes de coserla y cerrarla al final de la cirugía. Los fagos, al multiplicarse en contacto con las bacterias, se dispersarán y terminarán con la infección siempre y cuando queden bacterias sin infectar. Una vez que se elimine por completo la bacteria infecciosa, los fagos, que no pueden sobrevivir sin un huésped donde reproducirse, morirán también.
En los últimos años, se han presentado resultados muy prometedores usando fagos como terapia en varios casos considerados críticos, algo que, por desgracia, se está volviendo cada vez más común con el incremento gradual de la resistencia a los antibióticos. Algunos estudios demuestran que los fagos pueden reducir la creación de resistencia en las bacterias y consiguen acabar con infecciones causadas por Staphylococcus aureus, uno de los patógenos más peligrosos si genera resistencia a los antibióticos. Además, la gran especificidad de los fagos –capaces de reconocer no solo especies concretas de bacterias, sino en ocasiones incluso cepas distintas de una misma especie– permite ataques selectivos al patógeno responsable de la infección y consigue preservar a las bacterias “buenas”, técnicamente conocidas como bacterias comensales, que componen nuestra microbiota natural.
La terapia con fagos tiene un gran potencial como tratamiento alternativo a los antibióticos, sobre todo porque presenta una serie de ventajas muy significativas frente a los tratamientos tradicionales. A diferencia de los antibióticos de amplio espectro, que matan indiscriminadamente tanto a bacterias perjudiciales como beneficiosas, los fagos son extremadamente específicos, y están “programados” para atacar solamente a un tipo específico de patógenos. Esta especificidad reduce el riesgo de alterar la microbiota natural del cuerpo, esencial para mantener nuestra salud tanto física como mental. A veces, es necesario mejorar todavía más esta especificidad natural en el laboratorio, para lo cual se utilizan técnicas de edición genética como CRISPR.
Otra ventaja de los fagos es su capacidad para evolucionar –coevolucionar, en realidad– junto con las bacterias. Las bacterias pueden desarrollar resistencia a los antibióticos a través de mutaciones genéticas, es precisamente este mecanismo de defensa genético lo que vuelve ineficaces a nuestros medicamentos a lo largo del tiempo. Sin embargo, los fagos pueden evolucionar todavía más rápidamente para superar la resistencia bacteriana – son un arma dinámica y adaptable contra patógenos resistentes. Además, los fagos pueden llegar a penetrar en áreas de difícil acceso, como biofilms –comunidades de bacterias que viven en una matriz pegajosa de polisacáridos– e infecciones dentro de las propias células, donde los antibióticos pueden tener dificultades para penetrar. Esto hace que la terapia con fagos sea especialmente prometedora para tratar tanto infecciones crónicas como infecciones persistentes que no responden a los tratamientos con antibióticos convencionales.
Los fagos pueden administrarse por vía oral, tópica o intravenosa, según el tipo de infección y su ubicación. También pueden usarse en combinación con antibióticos para aumentar su eficacia y reducir el riesgo de desarrollo de resistencia. Además, se ha demostrado que los fagos tienen efectos inmunomoduladores, ayudando a impulsar la respuesta inmune natural del cuerpo ante las infecciones. También funcionan patógenos resistentes a los antibióticos, como han demostrado numerosos estudios y ensayos clínicos, incluidos organismos multirresistentes como Staphylococcus aureus, Escherichia coli y Pseudomonas aeruginosa.
Gracias a los avances recientes en bioingeniería –incluida la llegada de CRISPR– se han abierto nuevas posibilidades para mejorar el potencial terapéutico de los fagos. Los científicos pueden modificar y manipular el material genético de los fagos “a la carta”, creando nuevos virus todavía más selectivos, más específicos pero, sobre todo, más eficaces. También se puede programar a los fagos para que generen productos con potencial terapéutico in situ, directamente en el lugar donde son necesarios. En este sentido, la bioingeniería de fagos capaces de producir proteínas terapéuticas mejora la eficacia de la terapia, dado que permite modular la respuesta inmune. Además, pueden diseñarse nuevos fagos que mejoren la farmacocinética –la duración de los efectos y potencia de un tratamiento–, aumentando su estabilidad y prolongando su vida útil en el cuerpo. Más allá de la ingeniería genética, también pueden combinarse distintos tipos de fagos en los llamados “cócteles de fagos», mezclas con múltiples fagos que atacan diferentes frentes de la infección bacteriana. Estos cócteles no solo mejoran la eficacia del tratamiento, al poder dirigirse al mismo tiempo a múltiples cepas bacterianas, sino que además consiguen reducir el riesgo de desarrollo de resistencia al evitar la propagación de las bacterias.
Las investigaciones más recientes sugieren que los fagos podrían tener utilidad mucho más allá del tratamiento de enfermedades infecciosas, con aplicaciones potenciales en numerosos tratamientos. Por ejemplo, gracias a la cualidad de los fagos para modular las respuestas del sistema inmunitario, podrían utilizarse para tratar enfermedades autoinmunes – muchas de las cuales están creciendo en prevalencia debido a numerosos cambios en el estilo de vida. Varios estudios apuestan por los fagos para atacar de manera selectiva a células inmunitarias implicadas en trastornos autoinmunes como la artritis reumatoide o la enfermedad inflamatoria intestinal. Al eliminar estas células, los fagos podrían ayudar a amortiguar la respuesta inmunitaria –y, quizás más importante todavía, la respuesta inflamatoria– característica de estas afecciones. Los fagos también podrían convertirse en una potente herramienta para luchar contra el cáncer. Mediante la ingeniería genética, podrían modificarse el comportamiento de los virus bacteriófagos para transportar e inyectar cargas terapéuticas directamente dentro de las células cancerosas. Esto podría incluir la distribución de quimioterapia –normalmente sustancias citotóxicas que matan las células cancerosas– e inmunoterapia –el uso de proteínas y anticuerpos que actúan como inmunomoduladoras y estimulan la respuesta natural de nuestro sistema inmunológico contra los tumores.
También podrían usarse fagos en aplicaciones como la terapia génica contra el cáncer, que normalmente utiliza virus más complejos para transportar los fragmentos de ARN y ADN con potencial terapéutico. Esto puede lograrse modificando las proteínas de la superficie del fago para que sean capaces de reconocer y unirse, de forma específica y selectiva, a ciertos marcadores y receptores de células cancerosas. Ahora que también entendemos mejor las interacciones entre la microbiota intestinal y la aparición de ciertos tipos de cáncer, los fagos podrían diseñarse para atacar poblaciones bacterianas específicas dentro del intestino si están relacionadas con el crecimiento tumoral o la aparición de metástasis.
A pesar de los prometedores resultados de los últimos estudios con fagos, esta terapia todavía se enfrenta a la incredulidad de muchos, por un lado, y a la falta de fondos y regulación médica, por otro. Hace unos años, un ensayo clínico liderado por investigadores franceses estudió la terapia de fagos en quemaduras infectadas, financiado por la Comisión Europea con 3,8 millones de euros. Sin embargo, este estudio tuvo que interrumpirse por culpa de una serie de problemas, entre otros la dificultad para reclutar pacientes y la poca estabilidad de los fagos preparados. Además, los resultados preliminares indicaron que los fagos, efectivamente, ayudaban a reducir la infección bacteriana en algunos pacientes, pero de forma mucho más lenta en comparación con el tratamiento estándar de antibióticos. Este revés podría haber ralentizado la adopción de la terapia con fagos en Francia y, en consecuencia, en el resto de Europa.
Pero todavía hay motivos para el optimismo: Bélgica ha dado un paso significativo al aprobar el uso de los fagos como medicamentos personalizados, preparados por un farmacéutico cualificado si existe una prescripción médica. Jean-Paul Pirnay, un investigador belga, cree que “solo es una cuestión de tiempo” antes de que la terapia con fagos personalizados se convierta en una opción de tratamiento estándar en todo el mundo. Pirnay y otros científicos del campo sugieren la creación de un nuevo sistema regulatorio que permita el desarrollo de un catálogo de fagos probados y certificados, así como de “semillas” y fagos latentes, ambos necesarios para la creación de preparaciones personalizadas. Queda claro que, a pesar de su gran potencial, las aplicaciones de los fagos se encuentran todavía en una fase preliminar, donde todavía queda mucho camino por recorrer tanto en investigación y desarrollo como en regulación y legislación. La inversión en estas terapias es fundamental, especialmente considerando la crisis global de resistencia a los antibióticos ante la que nos encontramos, para poder comprender completamente los mecanismos de acción de los fagos y desarrollar mecanismos eficaces y seguros para su aplicación y su comercialización.
La difícil transición hacia la medicina con fagos
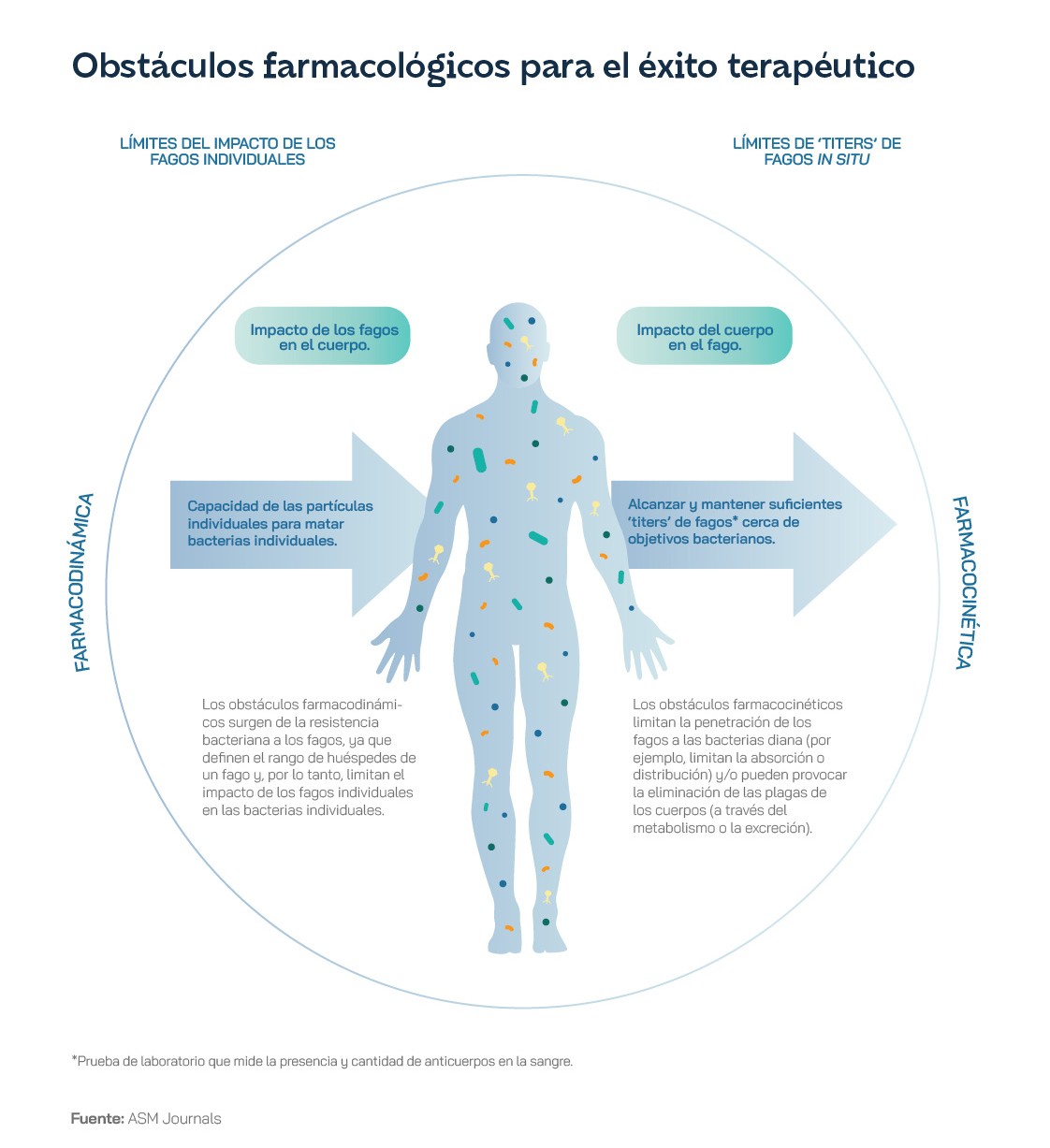
La OCDE estima que los países de la UE y el Espacio Económico Europeo gastarán hasta 1.100 millones de euros al año en atención sanitaria contra la resistencia a los antimicrobianos si no se controla el incremento de la incidencia, incluidos los costes derivados de una recuperación más lenta de la infección y los asociados al mayor riesgo de complicaciones, con hasta 569 millones de euros adicionales por días de hospitalización. El Banco Mundial calcula que la resistencia a los antimicrobianos podría costarle a la economía mundial entre uno y 3,4 billones de dólares al año en 2030. El uso de fagos para combatir estos patógenos se presenta como una de las alternativas más atractivas a las terapias convencionales, pero tiene todavía varios puntos débiles. Para empezar, puede resultar difícil y requerir mucho tiempo de investigación identificar qué patógeno debe erradicarse, qué fago se necesita y su dosis, potencia y capacidad. La interrelación entre un fago, la bacteria y su modificación después de entrar en contacto entre sí y con el medio ambiente también puede ser particularmente compleja y difícil de determinar. Además, los costes en la formulación y estabilización de preparaciones de fagos de calidad farmacéutica son distintos según las variantes que se utilicen y, al igual que ocurre con los antibióticos, existe la posibilidad de que las bacterias desarrollen resistencia a los fagos. En última instancia, y debido a que los fagos no son antígenos propios, sino que se originan fuera del cuerpo huésped, pueden ser reconocidos por el sistema inmunológico de un paciente y ser atacados, con lo que su eficacia se reduciría, cuando no generarían directamente anafilaxia, una respuesta autoinmune de los pacientes.
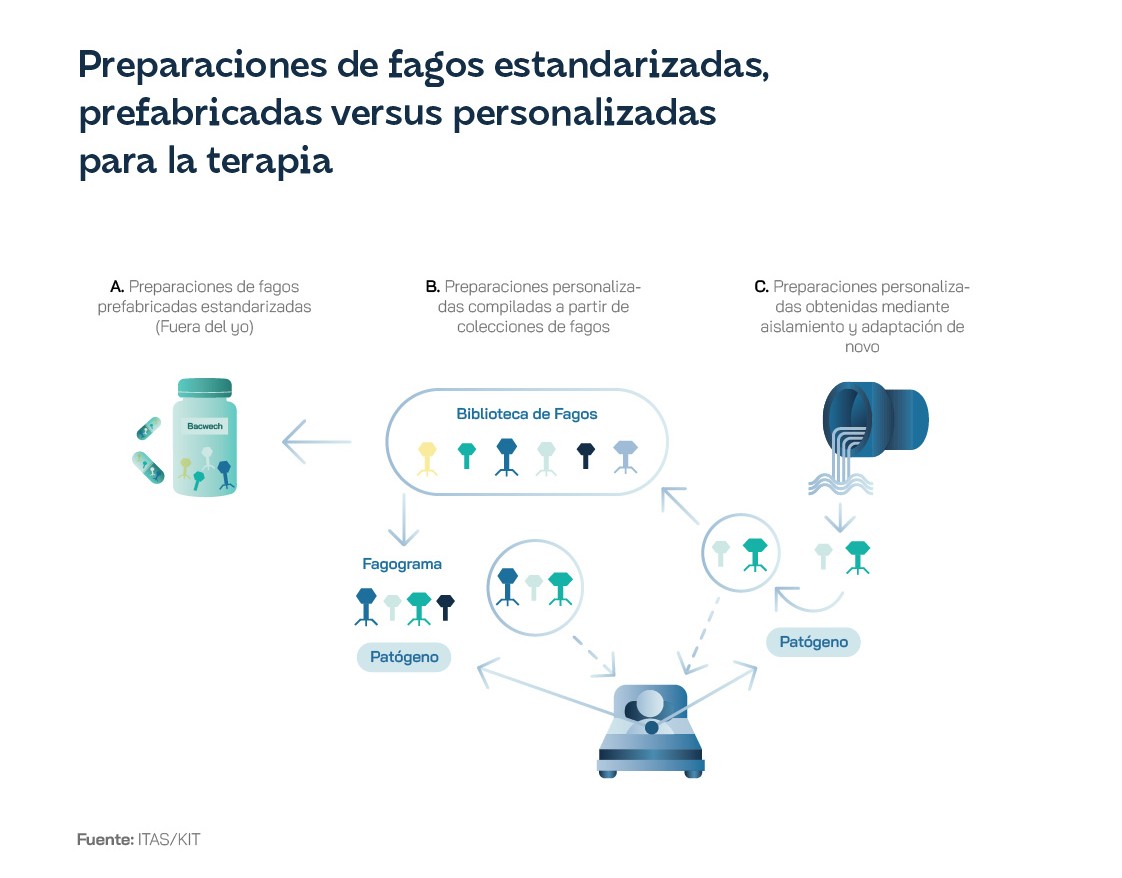
A pesar de todo ello, en algunos países, en especial Rusia y sus exsatélies durante la época soviética, las preparaciones de fagos se han convertido en medicamentos registrados, con centros de investigación dedicados. En Georgia, los pacientes son tratados con fagos de fabricación general o con fagos individualizados, si la bacteria es resistente a las variantes estándar. Los productos de fagos también se utilizan para la protección ambiental, el saneamiento y la descontaminación de diferentes ambientes contaminados con patógenos bacterianos. La empresa biofarmacéutica georgiana BioChimPharm completó en 2022 la modernización de su histórica fábrica de bacteriófagos con apoyo económico de la UE, el BERD, la FAO y su Ministerio de Economía y Desarrollo Sostenible. En Polonia, la Unidad de Terapia con Fagos (PTU) del Instituto Hirszfeld de Inmunología y Terapia Experimental en Wrocław ha tratado pacientes desde la década de 1950 y se le ha permitido continuar usando fagos en régimen de tratamiento experimental después de unirse a la UE en mayo de 2004. Desde entonces, y hasta 2020, más de 700 pacientes fueron tratados en el PTU. De hecho, los ha venido produciendo para pacientes en toda Europa y Norteamérica. Y las universidades de Jyväskylä y Helsinki llevan mucho tiempo investigando los fagos y, en algunos casos, los han proporcionado para tratamientos de emergencia. A través de su herramienta de inversión Unfund han impulsado PrecisionPhage para respaldar su expansión internacional.
El resto de países de la UE ha dado muestras de interés claras por este campo biomédico en los últimos años, pero la realidad es que, a principios de 2024, no existía ningún medicamento basado en fagos para uso humano aprobado según la legislación de la UE. En Eslovaquia y la República Checa existía uno, Stafal, pero entró en estos países antes de que ambos se unieran a la UE. Cuando se utilizan terapias con fagos en los Estados miembro, generalmente se hace a nivel de experimento individual o como parte de un ensayo clínico. La única excepción sería el enfoque magistral aprobado en Bélgica para facilitar el tratamiento con fagos. Consiste en un documento de tres páginas que «describe cómo producir un fago y realizar un control de calidad», y va firmado por un médico.
Polonia y Bélgica han tomado, por consiguiente, la delantera en la UE. Elegida como la startup de ciencias de la vida más innovadora de Europa en 2021, la belga Vésale Bioscience recibió 1,8 millones de euros del Consejo Europeo de Innovación, para desarrollar su plataforma pionera de terapia que produce fagos personalizados para infecciones bacterianas individuales en un plazo rápido de menos de 24 horas, cumpliendo los requisitos del estándar de Buenas Prácticas de Fabricación (GMP, por sus siglas en inglés). Mientras tanto, Francia y Alemania han optado por el camino más largo y están intentando promover tratamientos estándar, no personalizados, sino con enfoque general, para las infecciones bacterianas.
El invierno de los fagos Estados Unidos y Europa occidental parece estar acabando, pero de forma asimétrica. El surgimiento de los antibióticos en la década de 1920 provocó una disminución del interés y las terapias se limitaron a un pequeño número de centros de tratamiento experimental con médicos e investigadores a título casi individual. En el Reino Unido, se han utilizado sólo en 12 ocasiones en los últimos cuatro años, en dos pacientes con fibrosis quística en el Great Ormond Street Hospital y en 10 pacientes con infección del pie diabético en dos hospitales escoceses. En todos los casos en los que se han probado fuera de la órbita de los países del Este de Europa, los fagos han sido permitidos como productos medicinales sin licencia, o bajo normas nacionales específicas que han permitido que sean recetados por profesionales médicos, pero no fabricados para un uso más amplio, como sucede en Bélgica.
La terapia con fagos ha demostrado ser exitosa en el tratamiento de infecciones potencialmente mortales, con resultados que van desde la eliminación total de la infección hasta la mejora sustancial de la situación del paciente en el caso de afecciones que van desde fibrosis quística y neumonía hasta infecciones protésicas, óseas, articulares y del tracto urinario. Por eso, el Plan de Acción Nacional del Gobierno de EEUU para combatir las bacterias resistentes a los antibióticos, 2020-2025, tuvo que reconocer su potencial curativo e incluyó a los fagos dentro de su llamada a acelerar la investigación básica y aplicada, desarrollar nuevas terapias.
El Parlamento Europeo reconoció el gran potencial de los fagos en su Resolución sobre la acción de la UE para combatir la resistencia a los antimicrobianos, pero se limitó a solicitar un marco regulatorio adecuado para el registro de bacteriófagos como aditivos para piensos y como productos médicos veterinarios. En 2023, la Agencia Europea de Medicamentos dio un paso importante en ese sentido al publicar un marco de condiciones para la autorización de fagos como medicamentos para uso con animales. Esa decisión fue aprovechada por la organización PhageEU para reclamar el desarrollo de otros marcos similares, de modo que una amplia gama de productos de fagos pudieran ingresar en el mercado europeo. En la propuesta de la Comisión Europea para una nueva Directiva sobre medicamentos de uso humano, presentada en abril de 2023, los fagos aparecieron mencionados dentro de esa categoría. En cuanto a la posibilidad de los fagos transgénicos, la UE tiene regulaciones estrictas sobre los organismos genéticamente modificados, lo que podría ofrecer a otros países una ventaja competitiva en el desarrollo y explotación de esta línea de tratamientos.
En el campo regulatorio, sigue habiendo mucho camino por recorrer. En Francia, los fagos se obtienen en una preparación similar de tipo magistral, que proporciona la empresa Pherecydes Pharma o el hospital militar Reina Astrid de Bruselas a un farmacéutico de hospital. La Agencia Nacional de Seguridad de Medicamentos y Productos Sanitarios debe validar el uso de esos fagos a través de un comité de expertos. De acuerdo con la doctrina del TJUE, se puede suponer que la terapia con fagos tiene un efecto farmacológico en el sentido de la ley farmacéutica y, a nivel de la legislación de la UE, no existe ninguna prohibición para la terapia con fagos. Cada Estado miembro es competente para dar luz verde al tratamiento. Eso sí, para armonizar los medicamentos fagos sería necesario una autorización centralizada obligatoria de la UE y una disposición similar a la exención hospitalaria que garantice que, para los medicamentos fagos individualizados, los requisitos nacionales de trazabilidad y farmacovigilancia y las normas de calidad específicas son equivalentes a los que se aplican a nivel comunitario. Además, debería declararse de forma técnica y jurídicamente inequívoca que son medicamentos biológicos.
Las dudas que genera todavía su despliegue en los sistemas de salud se reflejan en las estimaciones sobre el potencial alcance económico del mercado mundial de terapia con fagos, que oscila entre los 167,71 millones de dólares en 2031, según las previsiones más conservadoras, y los 1.651,8 millones de las más expansivas al incluir sus aplicaciones en alimentos y bebidas. Los inversores se preguntan por qué deberían poner dinero en una tecnología que ya existe desde hace 100 años, pero que no ha sido adoptada ampliamente fuera de la ex Unión Soviética. Lo que hace diferente al momento actual de otros en el pasado es el análisis genómico, mucho más fácil y barato que en la era soviética, lo que permite a los investigadores seleccionar y diseñar mejor los fagos adecuados.
Puede ser la llave para que se cree el entorno institucional que necesita esta tecnología para escalar. En noviembre de 2022, Innovate UK estableció una Red de Transferencia de Conocimiento sobre Fagos. La Agencia Reguladora de Medicamentos y Productos Sanitarios tenía previsto publicar un borrador de orientación a finales de 2024 sobre la concesión de licencias de productos de fagos, que finalmente podría despejar las dudas sobre su regulación en el Reino Unido. La Colección Nacional de Cultivos Tipo de la agencia de salud británica es la biblioteca de cepas bacterianas más antigua del mundo, y su nuevo depósito pretende ser una fuente confiable a que los científicos puedan acceder y en la que depositen fagos.
Todo dependerá de que la eficacia clínica quede claramente probada. En mayo de 2024, había 78 ensayos de fagos abiertos en todo el mundo, según Clinicaltrials.gov. En los 59 llevados a cabo entre 2000 y 2021, el 79% de los pacientes con infecciones crónicas y resistentes a los medicamentos mostró una mejoría, mientras que el 87% de las bacterias objetivo fueron erradicadas. Se suele citar el experimento Phagoburn, financiado por la UE, que trabajó en un producto de fagos que contenía bacteriófagos anti-Escherichia coli y anti-Pseudomonas aeruginosa para combatir infecciones en pacientes quemados. Phage Australia lanzó un ensayo clínico innovador para evaluar el protocolo de administración y el seguimiento de la terapia con fagos, un paso más allá de los modelos centrados en fagos individuales o en cócteles. Este enfoque permitiría personalizarlos según las necesidades de cada paciente, al tiempo que estandarizaría la metodología de tratamiento y la recopilación de datos. Sin embargo, otros estudios plantean dudas sobre su éxito como antimicrobianos y recopilan también fracasos elocuentes, incluido un contundente informe de la Scottish Health Technologies Group, o la documentada mejoría y posterior muerte de un paciente tratado con fagos. Las investigaciones realizadas durante décadas en Europa del Este son numerosas, pero no cumplirían con los rigurosos estándares actuales. A esto hay que añadir el bajo nivel de concienciación entre los médicos. Sería necesaria una comprensión más profunda de la biología de los fagos y el rango de huéspedes para desarrollar métodos basados en fagos más eficaces y herramientas de diagnóstico adecuadas.
Un desafío importante para el desarrollo y uso de fagos es también la falta de capacidad de fabricación, principalmente porque los procesos regulatorios actuales parecen inadecuados para ello. En la mayoría de los países occidentales se les clasifica como un producto farmacéutico que requiere el estándar GMP, y eso implica un proceso de aprobación complejo, costoso y lento. La condición del fago como entidad biológica, que además suele aparecer en cócteles con otros fagos y otros agentes, como antibióticos, susceptible además de modificación genética, no ayuda a simplificar las cosas. Las terapias con fagos suelen diseñarse para tratar infecciones bacterianas específicas e incluso personalizadas para pacientes individuales, lo que contrasta con los productos farmacéuticos fijos asociados al modelo GMP. De ahí que, ante la posibilidad de que los fagos se utilicen de forma amplia, se esté planteando la conveniencia de establecer un régimen de licencias de medicamentos flexible y personalizado, que permita una combinación única de fagos, genéricos y diseñados, a menudo con antibióticos, y que dote a esta tecnología de la seguridad regulatoria necesaria para su producción y fabricación. Probablemente la solución más adecuada pase por promover la producción de GMP a gran escala para fagos genéricos y las soluciones individualizadas para pacientes que requieren combinaciones específicas. Esta tecnología requiere una respuesta ágil, que no contempla la normativa europea actual, según la cual las necesarias actualizaciones periódicas de los cócteles de fagos, para contrarrestar la resistencia de los fagos, requerirían de nuevas solicitudes de autorización de comercialización, largas y costosas.
Junto a ello, las compañías farmacéuticas necesitan más incentivos para invertir en una actividad que requiere en una primera fase de 200.000 euros para producir cada fago individual, según el estándar GMP, y en una etapa más avanzada de unos 585.000 euros para tratar a entre 100 y 200 pacientes con un solo lote de fagos GMP fabricados por contrato en la UE. En última instancia, Reino Unido estima que en el caso de poner en marcha una instalación GMP, con una inversión de entre 23,5 y 35,2 millones de euros, y teniendo en cuenta las economías de escala, el coste podría reducirse a un par de libras por paciente y se podrían lograr ahorros para el sistema de salud de entre 175 y 230 millones de euros al año sólo en el tratamiento de las infecciones por pie diabético, cadera y rodilla, gracias el recorte en el uso de antibióticos y la disminución de intervenciones como amputaciones y otras cirugías.
A principios de 2024, sólo Eslovenia, Portugal, Noruega y Estados Unidos contaban con instalaciones de fagos GMP. El Action Plan AMR de 2024 a 2029, que establecía las prioridades de investigación del Gobierno británico, incluía la innovación de nuevos productos para abordar la resistencia a los antimicrobianos. Uno de esos estímulos para el sector podría consistir en facilitar las patentes de combinaciones únicas de fagos y los fagos modificados. También ayudaría el acceso a datos sólidos de ensayos clínicos que ayuden reducir la llamada “brecha de traducción”, es decir, que impulsen el acceso a herramientas de genética molecular, secuenciación y biología computacional con las que garantizar que los fagos desarrollados para la terapia son seguros y efectivos.
La Organización Mundial de la Salud insiste en aplicar un enfoque One Health y abordar la resistencia a los antimicrobianos desde una perspectiva amplia que incluya la salud humana y animal, la cadena alimentaria y el medio ambiente. La realidad está todavía muy lejos de hacer posible esa visión a nivel sistémico. Por ejemplo, para que los fagos se transporten de manera eficiente entre países, debería haber un registro bien establecido, regulado y actualizado, pero no es así. La información nacional e institucional se publica hoy esporádicamente en una variedad de revistas científicas. Un enfoque One Health implicaría también la cooperación transdisciplinaria, porque hay mucho que aprender de las investigaciones sobre la aplicación de fagos en la agricultura. Se ha demostrado, entre otras aportaciones de utilidad para el sector sanitario, que el uso de preparaciones de fagos en prácticas previas al sacrificio disminuye la contaminación bacteriana patógena de la carne para consumo humano. En el contexto actual, obtener fagos de alta calidad es difícil, especialmente para quienes no están familiarizados con la terapia. El acceso a los fagos es informal y está impulsado en gran medida por la creación de redes entre médicos y laboratorios de fagos. Se realiza a través de fuentes internacionales dispares, generalmente no comerciales, y depende del pago por paciente de hasta 12.000 euros para el aislamiento y caracterización de los fagos.
Demasiado riesgo para los inversores. Pese a que el Foro Económico Mundial enumeró el uso de bacteriófagos como una de las 10 principales tecnologías emergentes de 2023, suele ser complicado conseguir financiación para ensayos clínicos, especialmente por parte de las empresas farmacéuticas, debido a su elevado coste especialmente cuando pasan a las fases II y fase III. Y sin ensayos clínicos, los países que no logren información en su territorio tendrán que utilizar los datos clínicos de otros países o de sectores no relacionados con la salud, como el agroalimentario. La FDA está liberando fondos en EEUU y los Institutos Nacionales de Salud destinaron un primer tramo de financiación de 2,5 millones de dólares a 12 institutos de todo el mundo para dinamizar las pruebas. En junio de 2018, se inauguró el Centro de Terapéutica y Aplicaciones Innovadoras de Fagos (IPATH), en la Facultad de Medicina de UC San Diego con el objetivo de brindar terapia con fagos a pacientes con infecciones resistentes a múltiples medicamentos bajo el programa de uso compasivo de la FDA. La startup Armata Pharmaceuticals recibió alrededor de 16,3 millones de dólares del Departamento de Defensa norteamericano, para la investigación del bacteriófago S. aureus, en relación con la resistencia a los antibióticos en Ucrania. El trabajo científico y tecnológico avanza mientras el ámbito institucional lleva a cabo su propia transición.
Iniciativas para llegar a la salud desde el campo
El único ensayo clínico sobre fagos en el que estaban implicadas entidades españolas de investigación en 2023, según ClinicalTrials, buscaba acreditar la validez de una terapia basada en bacteriófagos para pacientes con fibrosis quística e infección pulmonar crónica por pseudomonas aeruginosa, un tipo de bacteria aeróbica. Estaban presentes el Hospital Vall d’Hebron de Barcelona y el Hospital Clínico Universitario Virgen de la Arrixaca de El Palmar (Murcia), y los participantes debían ser pacientes mayores de edad, clínicamente estables que estuvieran recibiendo medicamentos estándar para la fibrosis quística.
En el ámbito de la ciencia básica, el Grupo de Investigación Traslacional y Multidisciplinar del Instituto de Investigación Biómédica de A Coruña (INIBIC) del Hospital A Coruña ha desarrollado diversas líneas de innovación en fagoterapia, y ha sido premiado por la asociación de empresas de biotecnología Asebio por la aplicación de la estrategia de anti-persistencia bacteriana, el principal mecanismo que utilizan las bacterias para defenderse de la infección por fagos. Su trabajo se centra en la eficacia de los fagos líticos naturales combinados con tratamientos potenciadores, y el desarrollo de fagos sintéticos que porten proteínas de interés para favorecer su actividad.
En España, es más habitual encontrar investigación acerca de los fagos en el ámbito agroalimentario, una vertiente que, como se ha visto, puede ofrecer posibilidades de aplicación posterior a humanos. El proyecto C-SNIPER busca obtener una solución basada en bacteriófagos innovadora, natural y eficiente para reducir la prevalencia del Campylobacter en aves de corral. Es causante de la campilobacteriosis, la enfermedad transmitida por alimentos más frecuente en Europa y la ruta más común de infección humana, con un coste asociado estimado de 2.400 millones de euros al año[4]. Pese a ello, no hay en el mercado productos a base de fagos que la combatan, como sí sucede con otros patógenos alimentarios como la Listeria monocytogenes, la Escherichia coli y la Salmonella. Las medidas de control actuales, basadas en el uso de antibióticos en las granjas, están provocando la propagación de cepas de Campylobacter multirresistentes. Por eso, la entidad europea EIT Food decidió financiar el proyecto C-SNIPER, en el que participan el centro científico y tecnológico español AZTI, el Instituto de Reproducción Animal e Investigación Alimentaria PAS (Polonia), la Universidad de Turín, el Phage Technology Center y ORA Società Agricola.
Investigadores de la Universitat Autònoma de Barcelona, formaron parte asimismo del proyecto europeo PhagoVet para desarrollar tres productos a partir de bacteriófagos para luchar contra la Salmonella y la Escherichia coli que supongan una alternativa al uso de antibióticos en producción animal. propone el uso de bacteriofagos para el control de los mencionados patógenos en producción aviar.


