
Las ‘tijeras’ genéticas conquistan el cuerpo
El descubrimiento de CRISPR se remonta a principios de la década de 1990, cuando el microbiólogo español Francisco Mojica descubrió una serie de secuencias repetitivas en el ADN de unas bacterias extremófilas, en particular unas bacterias adaptadas a vivir en ambientes de alta salinidad. Normalmente, el ADN es una secuencia de código diverso, un libro con las instrucciones que necesitan las células para fabricar proteínas. Las repeticiones observadas por Mojica eran una anomalía. Además, presentaban la curiosidad de ser prácticamente palindrómicas: podían leerse del derecho y del revés. En 1993, publicó un artículo en el que identificaba estas secuencias repetitivas y las bautizaba como «repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas», también abreviado como CRISPR, por sus siglas en inglés. Aunque al principio este descubrimiento pasó desapercibido, una década después la comunidad científica comenzó a interesarse por el origen y las razones evolutivas que se encontraban detrás de estas misteriosas secuencias palindrómicas. En 2007, varios científicos descubrieron que las secuencias CRISPR formaban parte del sistema inmunitario de las bacterias, que utilizaban esta tecnología genética para ‘aprender’ a luchar contra los virus y resistir las infecciones.
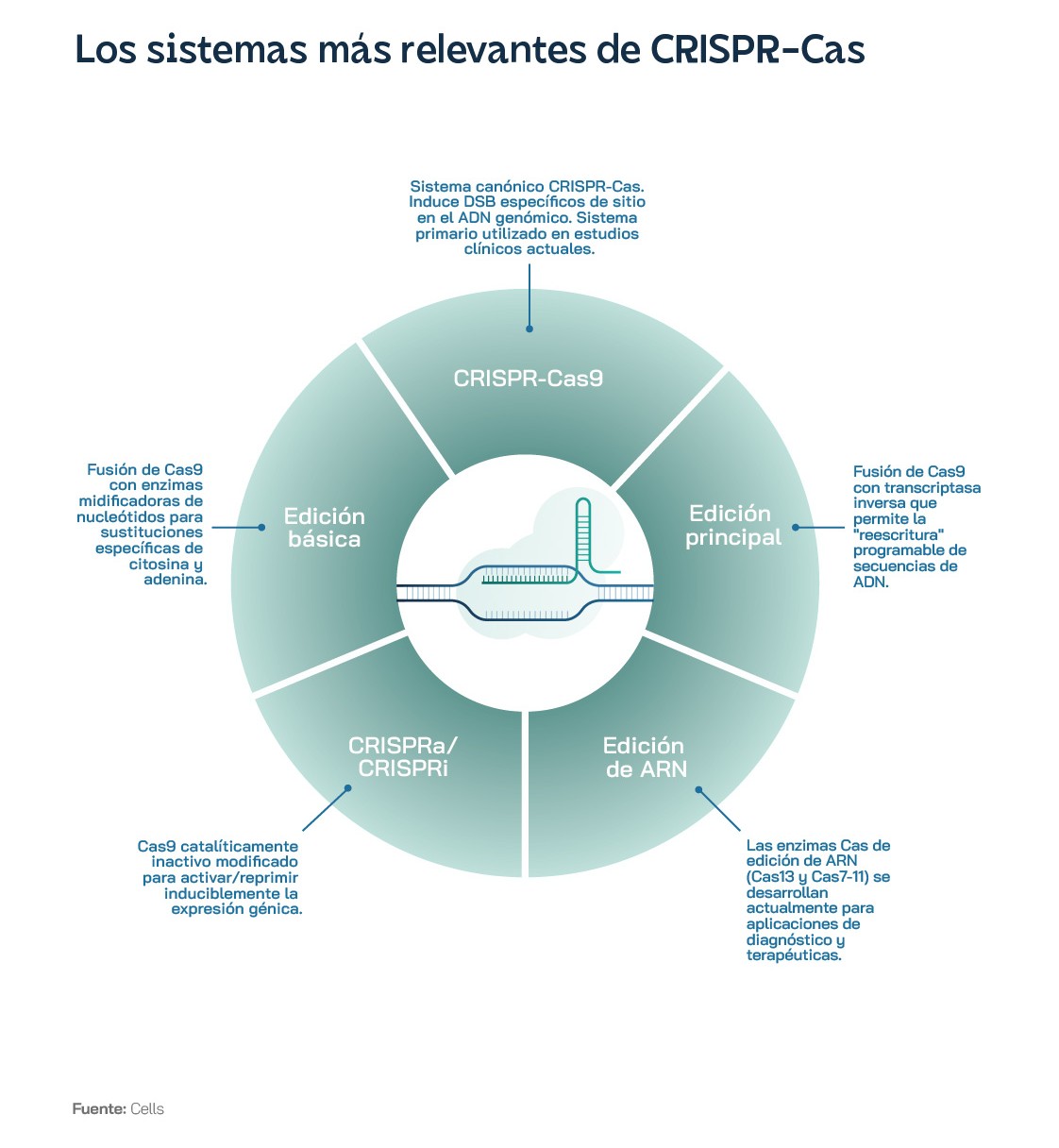
Poco después, llegó la verdadera revolución. A comienzos de la década de 2010, los científicos empezaron a explotar el mismo sistema CRISPR que utilizan las bacterias para protegerse como una herramienta de edición del genoma. En 2012, las investigadoras Jennifer Doudna y Emmanuelle Charpentier, galardonadas pocos años después con el Premio Nobel de Química, publicaron un artículo revolucionario en el que describían cómo podían reprogramar el sistema CRISPR para “cortar y pegar” secuencias específicas de ADN en el laboratorio. Doudna y Charpentier demostraron que podían diseñar una guía de ARN para dirigir a una enzima, llamada Cas9, a secuencias específicas de ADN, para luego cortarlas con una precisión sin precedentes. Este proceso permitió a los científicos editar el genoma con una facilidad y precisión únicas. Desde entonces, la tecnología CRISPR ha experimentado un desarrollo vertiginoso, hasta el punto de que ya existen tratamientos eficaces para humanos con enfermedades genéticas como la anemia falciforme, desarrollado por la empresa farmacéutica Vertex y autorizado por las agencias reguladoras de Reino Unido y Estados Unidos. Además, se han desarrollado varias variantes de la técnica original, con enzimas más avanzadas como CRISPR-Cas12 y CRISPR-Cas13, que permiten editar el genoma con una mayor precisión y eficiencia.
Uno de los hitos más importantes en la historia de CRISPR fue la primera demostración en la edición del genoma de células humanas. En 2013, un equipo de científicos dirigido por Feng Zhang, del Instituto Broad en Estados Unidos, publicó un artículo en el que describían esta tecnología y demostraban que podían conseguirse modificaciones genéticas en apenas un par de semanas. Este avance abrió nuevas posibilidades para la investigación médica y el desarrollo de terapias génicas.
Otro hito importante en la investigación de CRISPR fue la aplicación de la tecnología para corregir mutaciones genéticas en modelos animales. En 2014, un equipo de científicos dirigido por Kathy Niakan, del Laboratorio de Biología Molecular en Reino Unido, utilizó CRISPR para corregir una mutación genética en embriones de ratón, para demostrar que CRISPR podría utilizarse para tratar enfermedades genéticas hereditarias. Pocos años después, este mismo equipo utilizó esta tecnología en embriones humanos, gracias al permiso de las autoridades sanitarias inglesas. La posibilidad de modificar la secuencia genética de embriones humanos ha generado una gran polémica en la comunidad científica internacional, debido a las implicaciones éticas y filosóficas de poder programar personas “a la carta” mucho más allá de simplemente borrar algunos problemas hereditarios.
A pesar de los retos de regulación y los dilemas éticos, la investigación de CRISPR ha continuado avanzando a un ritmo vertiginoso. Como veremos más adelante, se han desarrollado nuevas aplicaciones de la tecnología, como la edición del genoma en plantas, la modificación de la microbiota intestinal y la detección de enfermedades infecciosas. Además, los científicos están explorando la posibilidad de utilizar CRISPR para desarrollar terapias génicas para una amplia variedad de enfermedades más allá de la anemia falciforme, desde el cáncer hasta las enfermedades genéticas raras.
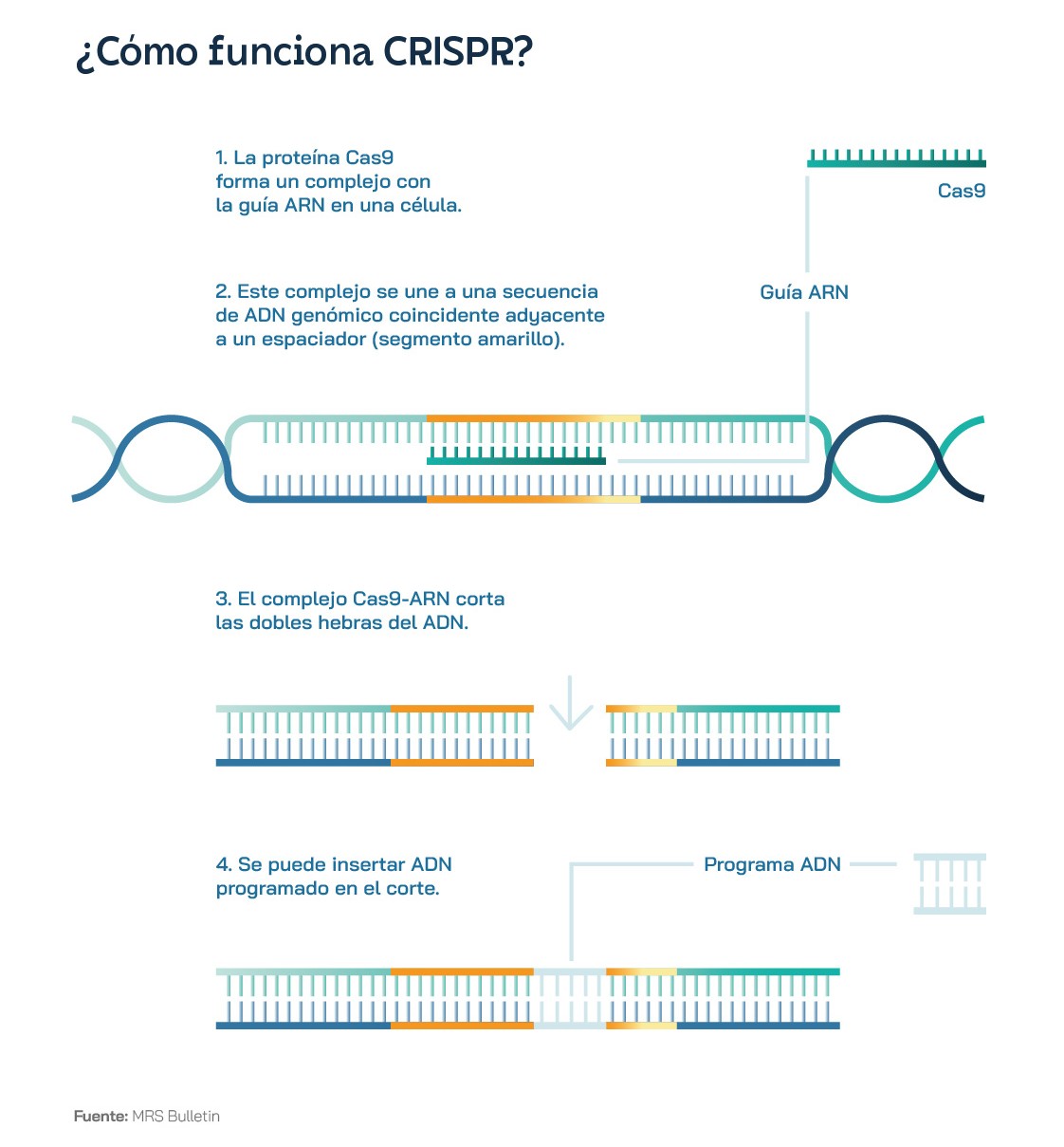
Claramente, la tecnología de edición genética CRISPR-Cas9 ha revolucionado el campo de la biotecnología y, pronto, revolucionará la medicina de precisión, gracias a su capacidad para editar el ADN de manera precisa y eficiente. Pero ¿cómo funciona exactamente esta poderosa herramienta? La clave es una proteína llamada Cas9, que actúa como una tijera molecular, capaz de cortar fragmentos de ADN. Guiada por una sencilla hebra de ARN, conocida como ARN guía, la proteína Cas9 puede localizar y cortar el ADN con precisión. A partir de esta ingeniosa solución del sistema inmunitario de las bacterias, los científicos han creado un sistema de “corta y pega” capaz de editar el ADN de células humanas, animales y vegetales. En lugar de dirigirse al genoma de un virus, como ocurriría de forma natural en las bacterias, el ARN guía sintetizado en el laboratorio dirige a Cas9 hacia una secuencia específica de ADN en el genoma.
Así pues, la tecnología CRISPR consta de dos componentes principales: el ARN guía y la proteína Cas9. El ARN guía es una molécula de ARN –como las utilizadas en algunas de las vacunas contra la COVID-19– diseñada para ser complementaria a la secuencia específica de ADN que se desea editar. De este modo, la secuencia de ARN guía y la secuencia de ADN a editar encajarán como una llave en una cerradura. Una analogía que probablemente sea más visual y acertada sean las dos cintas de una cremallera. El ARN guía se une a la proteína Cas9 formando un complejo que recorre y “escanea” el genoma en busca de una secuencia de ADN que coincida con la secuencia complementaria de la guía. Una vez estos dos fragmentos se encuentran, la proteína Cas9 deja de moverse a lo largo de la cadena de ADN y empieza a funcionar como una enzima capaz de cortar el código genético. En ocasiones, los expertos se refieren a esta enzima como una «tijera molecular» que corta el ADN en el sitio específico definido por el ARN guía. Una vez que el complejo Cas9-ARN guía se ha unido al ADN objetivo, la proteína Cas9 corta ambos filamentos de ADN, creando una ruptura de doble cadena en el ADN. A continuación, son los propios mecanismos de reparación que tiene de forma natural la célula los que entran en juego.
Estos sistemas incluyen, entre otros, la reparación por unión de extremos no homólogos y la reparación por recombinación homóloga. El primero simplemente une los extremos rotos del ADN. El segundo, en cambio, es mucho más interesante, porque la célula utiliza una molécula de ADN homóloga como plantilla para reparar la rotura ocasionada por Cas9. Esto permite a los científicos insertar o reemplazar secuencias específicas de ADN en el genoma. Una de las características más impresionantes de CRISPR-Cas9 es su precisión y eficiencia. Entre otras cosas, puede cortar el ADN en el sitio objetivo con una eficacia superior al 90%.
Todos los seres vivos tienen un genoma. Bacterias, hongos, plantas, animales y seres humanos usamos las mismas herramientas moleculares para guardar las instrucciones de la vida. Esto implica que las aplicaciones de CRISPR son prácticamente infinitas. La tecnología puede utilizarse para editar el genoma de plantas para hacerlas más nutritivas –o incluso más productivas y resistentes ante los problemas que crea el cambio climático–, para parar la transmisión de enfermedades genéticas hereditarias, para crear nuevas herramientas en nuestra lucha contra las bacterias y, especialmente, las bacterias resistentes, y para editar el genoma de los embriones humanos. Esto último tiene unas implicaciones éticas muy complejas, pero podría ayudar a erradicar enfermedades como la hemofilia, la fibrosis quística y muchas otras.
En agricultura, los científicos están empezando a estudiar las aplicaciones de CRISPR para editar los genes de diferentes cultivos y hacerlos más sabrosos, nutritivos, incluso más resistentes a las inclemencias meteorológicas y al estrés, dos factores que aumentarán el riesgo conforme avance la crisis climática. Por ejemplo, podría utilizarse CRISPR para reducir la cantidad de agentes alérgenos en los cacahuetes o permitir que los plátanos sobrevivan a una enfermedad mortal causada por hongos patógenos. Recientemente, grandes empresas multinacionales como Monsanto y DuPont han comenzado a comprar licencias para explotar la tecnología CRISPR y desarrollar nuevas variedades de cultivos más interesantes, para complementar su investigación en técnicas tradicionales de organismos modificados genéticamente. Frente a estas técnicas desarrolladas en las décadas de 1970 y 1980, CRISPR ofrece una alternativa de edición genética mucho más rápida, precisa y versátil, que puede ayudar a identificar genes asociados con características deseables de una forma más eficaz.
CRISPR también acelera la detección y el tratamiento de enfermedades genéticas, con casos como la edición del genoma para eliminar la miocardiopatía hipertrófica, la enfermedad de Huntington, la fibrosis quística y están las mutaciones BRCA-1 y 2, relacionadas con los cánceres de mama y ovario. Sin embargo, hasta ahora la única aplicación aprobada de la tecnología CRISPR es el tratamiento de la anemia falciforme, un problema genético y hereditario que afecta los glóbulos rojos, dándoles una forma de hoz en lugar de la forma normal, redonda, lo que ocasiona varios problemas de salud. Este es un caso especial, porque tan solo necesita la edición de una “letra” del ADN y puede aplicarse directamente en adultos. De momento, la tecnología ha visto que reduce los problemas y el dolor en más de 100 pacientes durante al menos un año, aunque se desconocen los efectos a largo plazo. Aún quedan obstáculos que superar antes de que alguien comience otros ensayos clínicos en humanos, para el tratamiento de enfermedades más complejas. Por ejemplo, las enzimas Cas9 pueden ocasionalmente “fallar” y editar el ADN en lugares inesperados, lo que podría desembocar en cáncer o incluso crear nuevas enfermedades. Algunos expertos creen que la capacidad de CRISPR para causar estragos y problemas serios en el ADN ha sido “gravemente subestimada”. Actualmente, los estudios científicos se centran en identificar estos problemas, implementar las terapias de forma paulatina y con precaución y desarrollar nuevos avances que mejoren todavía más la precisión y la seguridad a largo plazo de la tecnología CRISPR. Entre otros avances, se desarrollan nuevas proteínas y enzimas similares a Cas9, como Cas12 y Cas13, que solucionan algunos de estos inconvenientes y otorgan más precisión a los sistemas de edición genética.
La lucha contra las bacterias resistentes a los antibióticos y las enfermedades infecciosas, como el virus del Zika, cuya incidencia no deja de crecer por los efectos de la crisis climática, también podría abordarse con CRISPR. En el primer ejemplo, la edición genética podría puentear el desarrollo de nuevos antibióticos, gracias al desarrollo de nuevas estrategias de ataque que modifiquen el ADN de los patógenos. Estas técnicas también se están utilizando contra infecciones víricas como el sida y las infecciones por herpes. Asimismo, podría utilizarse CRISPR en técnicas de “ingeniería dirigida” para modificar el código genético no solo de un organismo, sino de toda una especia a través de la propagación y la herencia. Esto permitiría, por ejemplo, modificar genéticamente los mosquitos, vectores de enfermedades como el Zika o la malaria, para que solo produzcan descendencia masculina. Con el tiempo, la población se extinguiría. También podrían hacerse mosquitos resistentes a los parásitos, para prevenir la transmisión de enfermedades a otras especies, incluidos los humanos.
Más recientemente se han presentado resultados prometedores que utilizan CRISPR para mejorar las terapias contra el cáncer, de forma que consiguen mejorar la eficacia a través de la reprogramación genética para conseguir unos tratamientos más personalizados. En un estudio clínico inicial con 16 pacientes con diferentes tipos de cáncer, como cáncer de colon, mama y pulmón, un grupo de científicos liderados por el español Antoni Ribas, utilizó CRISPR para mejorar la inmunoterapia contra estos tumores. Gracias a las ediciones genéticas, los científicos pudieron reprogramar el sistema inmunitario de los pacientes para que atacara específicamente las células cancerosas, dejando intactas a las células sanas. Este avance ofrece una nueva esperanza en la lucha contra el cáncer. De forma natural, nuestro sistema inmunitario lucha contra células cancerosas cada día. El problema es que, a medida que el cáncer crece, la capacidad de combatir contra la enfermedad disminuye de manera progresiva. Esta tecnología, sin embargo, consigue aislar los receptores y anticuerpos específicos para las células cancerosas en muestras de sangre y, tras un análisis exhaustivo, utiliza CRISPR para programar al resto de células del sistema inmunitario, que “aprenden” a crear los mismos anticuerpos y consiguen destruir el cáncer de forma más precisa y más eficaz. Este enfoque personalizado, al utilizar las propias células y receptores del paciente, reduce el riesgo de efectos secundarios y se aumenta la probabilidad de éxito del tratamiento.
A pesar del gran potencial de esta tecnología para revolucionar la agricultura, la biotecnología y los tratamientos de medicina de precisión, CRISPR plantea una serie de desafíos éticos, sociales y técnicos que deben abordarse de manera rigurosa. En primer lugar, en cuanto a las consideraciones éticas, la capacidad de editar el genoma –especialmente el genoma humano– con tecnologías como CRISPR-Cas9 y sus versiones mejoradas plantea una serie de preguntas difíciles. Por ejemplo, surgen debates sobre el uso y la modificación de embriones humanos, dado que además de la corrección de problemas relacionados con la salud, podrían alterarse otros factores como la inteligencia o la apariencia física, un concepto que roza los horrores de la eugenesia y la selección artificial. Estas ediciones genéticas podrían alterar la diversidad genética de la especie –una de las principales ventajas evolutivas – y abrir la puerta a la «ingeniería» de seres humanos, un fenómeno que no haría sino incrementar las diferencias y las desigualdades en la sociedad.
Además de las consideraciones éticas, existen desafíos técnicos relacionados con la reproducibilidad y la seguridad. Por ejemplo, el sistema no siempre corta el ADN de manera precisa y puede causar mutaciones no deseadas. Es fundamental mejorar la precisión y la eficiencia de la tecnología para garantizar su seguridad y efectividad. Además, también se deben abordar preocupaciones sobre la capacidad de CRISPR para editar varias secuencias genéticas simultáneamente y los posibles efectos no deseados de estas ediciones. Por último, quedan muchas preguntas por responder en el campo de las patentes –uno de los casos sobre propiedad intelectual más mediáticos de los últimos años– y la regulación de la tecnología CRISPR-Cas9. Esta tecnología plantea desafíos regulatorios a distintos niveles y requiere una legislación estricta y extremadamente clara sobre cómo y cuándo se puede utilizar. Es necesario garantizar que CRISPR se utilice de manera ética y segura, para evitar un uso indebido o irresponsable. Jennifer Doudna, una de las pioneras de CRISPR, actualmente trabaja por difundir y debatir las implicaciones éticas y legales de las tecnologías de edición genética y, entre otras cosas, ha co-fundado un instituto de investigación que promueve “el bien común” para desarrollar soluciones contra enfermedades, el hambre y problemas sociales como la crisis climática. En resumen, esta herramienta revolucionaria descubierta en la Costa Blanca tiene el potencial de transformar la medicina, la agricultura y la biotecnología, pero plantea una serie de desafíos éticos, sociales y tecnológicos que deben abordarse de manera rigurosa para minimizar los riesgos y proteger el bienestar de la sociedad.
Reconstruir la sanidad desde los genes
La Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido fue la primera autoridad en aprobar el Casgevy en noviembre de 2023. Se trata de la primera terapia CRISPR para anemia falciforme y beta talasemia dependiente de transfusión (TDT), desarrollada por la norteamericana CRISPR Therapeutics en alianza con la irlandesa Vertex. La Administración de Alimentos y Medicamentos de EEUU (FDA) siguió sus pasos, con una aprobación inicial para la anemia de células falciformes en diciembre de 2023 y para la TDT en enero de 2024. Finalmente, la Comisión Europea hizo suya la opinión positiva adoptada por la Agencia Europea de Medicamentos (EMA), en diciembre de 2023, aunque acabó concediendo una autorización de comercialización condicionada para un año, renovable anualmente a medida que se informen más datos clínicos.
A pesar de la primera ola de aprobaciones de terapias celulares y genéticas, la industria aún está en su etapa inicial y las diferencias geográficas entre las autoridades regulatorias no contribuyen a clarificar el terreno de juego. El sector biotecnológico asociado al CRISPR aún tiene que ahormar las regulaciones a sus novedosas necesidades, y los Estados están optando por las posiciones más estrictas mientras no se resuelvan los interrogantes todavía abiertos. Se necesita fijar estándares de calidad que permitan poner en marcha estrategias que ayuden a escalar la tecnología. Mientras tanto, se da la paradoja de que la primera terapia con células T con receptor de antígeno quimérico (CAR), Kymriah del gigante Novartis, se aprobó en 2017, y el coste de desarrollar una nueva terapia celular o genética ronda los 1.940 millones de dólares, teniendo en cuenta la tasa de abandono de la investigación y el desarrollo, pero desde la perspectiva de los responsables públicos vivimos en un mundo en el que un laboratorio modestamente financiado y con un equipo pequeño de técnicos capacitados puede usar CRISPR para alterar el genoma humano, y ese es un hecho a la vez estimulante y aterrador. Europa ha advertido, por ejemplo, de que existe una necesidad urgente de definir y armonizar los criterios con base científica que deben determinar la gravedad de una enfermedad para que se justifique la edición genómica. Una actividad no controlada puede plantear grandes riesgos sociales y éticos, de modo que es partidaria de un marco regulatorio estricto. Al Parlamento Europeo no le basta, en ese sentido, la expresión «mejora humana» como criterio para este tipo de intervenciones, lo considera vago, cargado de valores y difícil de aplicar. Prefiere establecer los tipos de edición que deberían prohibirse o restringirse, y dotarse de un enfoque multinivel basado en el riesgo.
Dado que el mercado está fragmentado, las contribuciones al esfuerzo de coordinación regulatoria deben provenir no sólo de los gobiernos nacionales, sino también de las instituciones supranacionales. Esto al final se traduce en incertidumbre para los inversores, una indeterminación que está condicionando el desarrollo de una industria que cuenta con un sustrato científico-tecnológico de primer nivel en los países occidentales. Los fondos de inversión con sede en Europa han crecido significativamente desde 2010 y están logrando tasas internas netas de rendimiento sobre inversiones en las últimas etapas del 15%, en comparación con el 13% en EEUU. Sin embargo, este país cuenta con 22 fondos para biotecnología de más de 1.000 millones de dólares, en comparación con sólo uno de este tamaño en Europa. Las dudas regulatorias no facilitan tampoco el fomento de una cultura empresarial que asuma riesgos: el mercado europeo representó solo el 24% de las nuevas empresas de biotecnología del mundo entre 2018 y 2020, en comparación con el 65% de Estados Unidos. China ha pasado en ese tiempo del 8% al 12%.
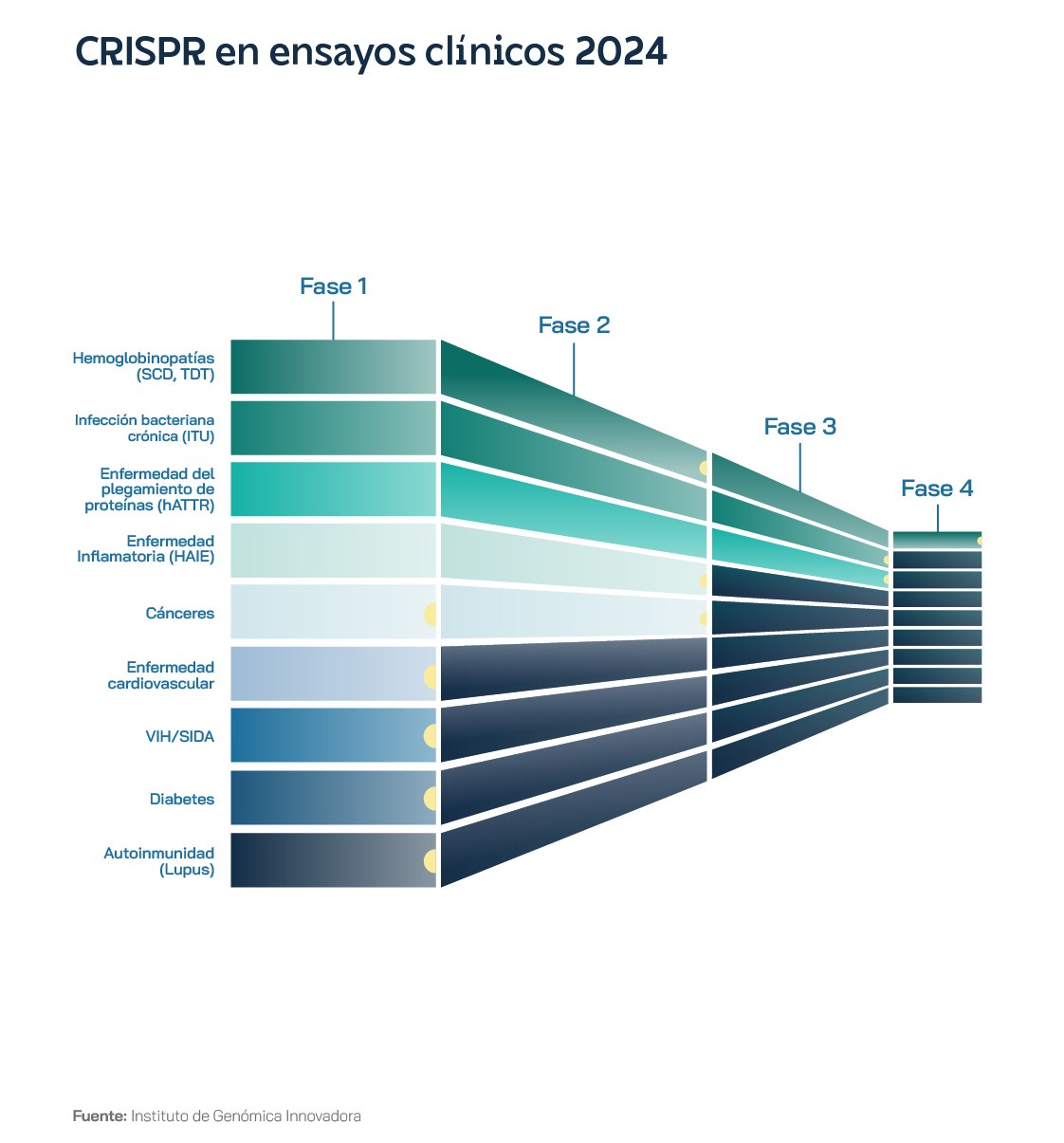
Los datos de capital riesgo y startups producen un profundo contraste con el hecho de que las principales vacunas contra la COVID-19 fueron desarrolladas por científicos en Europa: la de Pfizer-BioNTech y la de AstraZeneca. Más incluso en el caso de España, donde el investigador Francis Mojica descubrió los principios teóricos del CRISPR, pero no se ha registrado ni una sola patente relacionada con su trabajo. No debe extrañar que el 95% de las empresas biotecnológicas europeas que cotizan en EEUU lo haga en el Nasdaq. Se prevé que el mercado de terapias celulares y genéticas desarrolladas a partir de fuentes tanto alogénicas (el material celular proviene de diversos individuos de la misma especie) como autólogas (es del mismo individuo que recibe el tratamiento) alcance casi 160.000 millones de dólares en 2028. Los medicamentos autólogos liderarán el camino, contribuyendo con 83.000 millones de dólares, frente a los 74.000 millones de dólares de las terapias alogénicas. La mayoría de las 3.951 terapias celulares y genéticas en desarrollo se encontraban en la fase preclínica a principios de 2024, y el siguiente grupo más grande era la de terapias en fase de descubrimiento. Una cuarta parte de ellas estaban diseñadas para tratar diferentes formas de cáncer, seguidas de enfermedades que afectan al sistema nervioso central y afecciones oftálmicas. En 2.111 casos eran terapias genéticas, incluidas las terapias celulares genéticamente modificadas, como las terapias de células T con CAR, mientras que las terapias celulares genéticamente modificadas ascendían a 878. El 97% de las terapias con células CAR-T en desarrollo estaban dirigidas a suprimir distintas variantes de cáncer y el resto incluían esclerodermia, VIH/SIDA y enfermedades autoinmune. De las 1.038 terapias genéticas en desarrollo para enfermedades raras, ocho de las 10 principales eran también oncológicas, encabezadas por mieloma, leucemia mielógena aguda, linfoma no Hodgkin, linfoma de células B y cáncer de ovario.
Pensando en los ciudadanos, la clave es que todas esas tareas pendientes de armonización estratégica no obstaculicen el acceso a opciones terapéuticas experimentales o recientemente aprobadas, incluida la participación en ensayos clínicos. En ese sentido, es lógico admitir que la vía del ensayo clínico tradicional para un tratamiento que podría acabar administrándose a 10 pacientes al año, como sucede con las terapias genéticas, no puede ser la misma que la del tratamiento que se administrará a 100.000 o a millones, como sucede con los fármacos más populares. Para facilitar los tratamientos minoritarios, Europa ha instituido la Norma de Exención Hospitalaria, destinada a beneficiar a las personas con enfermedades ultrarraras. En España, la autorización de estos medicamentos de terapia avanzada de fabricación no industrial está regulada en un Real Decreto, según el cual los medicamentos reciben una autorización de uso en el marco de una institución hospitalaria y sólo para el tratamiento de un paciente individualizado.
El problema es que el espectro de tecnologías no deja de complicarse: desde el CRISPR Cas9 inicial, que se configuraba como un sistema de edición simple, se ha pasado a un amplio abanico de editores, editores base y prime editing, mucho más complejos. Junto a ello, hay que conciliar los productos personalizados con el desarrollo de procesos repetibles que arrojen resultados reproducibles, algo cada más crítico a ojos de los reguladores. Una de las claves consiste en facilitar que los innovadores trabajen con las autoridades lo antes posible en el análisis del ciclo de vida del producto con objeto de comprender sus requisitos de aprobación. EEUU se ha propuesto asimismo mejorar la armonización con otros reguladores en el ámbito de las terapias genéticas, especialmente en el caso de las enfermedades raras, que afectan a pocos individuos. Además, su estrategia contempla apoyar a las pequeñas empresas y, para ello, la FDA ha lanzado un piloto de programa de Apoyo a los Ensayos Clínicos que Avanzan en la Terapia de Enfermedades Raras (START), que utiliza métodos similares a los empleados en su día por el Proyecto Warp Speed, durante el desarrollo de la vacuna COVID-19, para apoyar el desarrollo de terapias genéticas.
El aumento previsto de la demanda plantea dudas también acerca de las posibles limitaciones en la capacidad actual y futura de fabricación de soluciones médicas basadas en CRISPR. La fabricación a escala de fármacos de terapia celular implicaría producir lotes de hasta 2.000 litros en formatos desechables de un solo uso, lo que limita las opciones de cualquier empresa de biotecnología. Si la terapia pudiera llegar a cientos o miles de pacientes, las empresas tendrían que generar entre 1011 y 1014 células al año, lo que supondría una gran carga para el área de operaciones. Los procesos que permitan una administración más rápida de la terapia CAR T tendrán, por consiguiente, un valor esencial una vez que esta opción de tratamiento se convierta en el estándar de atención. En el ámbito de las vacunas, preocupa la bien documentada escasez de vectores virales, dado que se espera que el número de aprobaciones crezca en los próximos cinco años y hay relativamente pocos sitios de fabricación por contrato en todo el mundo. La misma necesidad de mayor eficiencia se aplica a la producción de vectores lentivirales para terapias celulares modificadas genéticamente, en las que se necesita un procesado posterior rápido y optimizado debido a problemas de estabilidad con el tiempo.
La cuestión del precio está abriendo un fuerte debate ético. Si bien las dosis únicas de la terapia CAR T cuestan unos cientos de miles de dólares, las terapias genéticas disponibles en el mercado valen millones. Vertex y CRISPR Therapeutics fijaron un precio de 2,2 millones de dólares para el tratamiento único de Casgevy, aunque a principios de 2024 no habían concretado cuál sería el que aplicarían en Europa, donde el acceso se determina a partir de las negociaciones con las autoridades nacionales. Vertex ha organizado un acceso temprano para los pacientes de TDT en Francia antes del reembolso nacional y tenía previsto abrir en Europa 25 centros de tratamiento autorizados, tres de los cuales estaban operativos en el momento del anuncio. El mismo día que la FDA aprobó Casgevy para la enfermedad de células falciformes, dio el visto bueno también la terapia génica basada en células Lyfgenia de Bluebird Bio que se sumaba al que recibió también, en agosto de 2022, su terapia genética Zynteglo para tratar la TDT. Lyfgenia tenía un precio de 3,1 millones de dólares en 2024, mientras que el de Zynteglo era de 2,8 millones. Por si fuera poco, además de las cuestiones de acceso y fijación de precios, existen consideraciones de riesgo. La quimioterapia requerida antes de administrar el tratamiento CRISPR es dura para los pacientes y conlleva el riesgo de efectos secundarios graves.
Hay varias áreas en las que los fabricantes pueden centrarse para reducir el coste de las terapias. Los métodos tradicionales de fabricación implican procesos manuales realizados por trabajadores altamente calificados y experimentados en un ambiente de sala limpia. La transición de la fabricación a un entorno automatizado se presenta como un paso fundamental para aumentar la eficiencia. En el ámbito de la terapia celular, está surgiendo un enfoque innovador complementario para reducir costes, con empresas como Umoja Biopharma a la cabeza, que implica el uso de terapia génica para permitir que el propio cuerpo sea el que fabrique células diseñadas para el tratamiento, evitando el cuello de botella de fabricación tradicional y abriendo nuevas posibilidades para soluciones más efectivas y personalizadas.
Otro factor determinante para dar viabilidad a las nuevas terapias es el alto precio de las materias primas, en particular de los medios de cultivo celular especializados, ricos en factores de crecimiento y citoquinas. El desarrollo de una generación más eficiente de medios de cultivo celular, con un mayor uso de componentes recombinantes, podría contribuir a abaratar las terapias. Finalmente, las innovaciones dirigidas a crear productos bajo la fórmula de ‘listos para usar’ sigue siendo un enfoque crítico en este campo, y empresas como Be Biopharma y Neurona Therapeutics vienen trabajando activamente en tratamientos alogénicos que tienen el potencial de reducir costes.
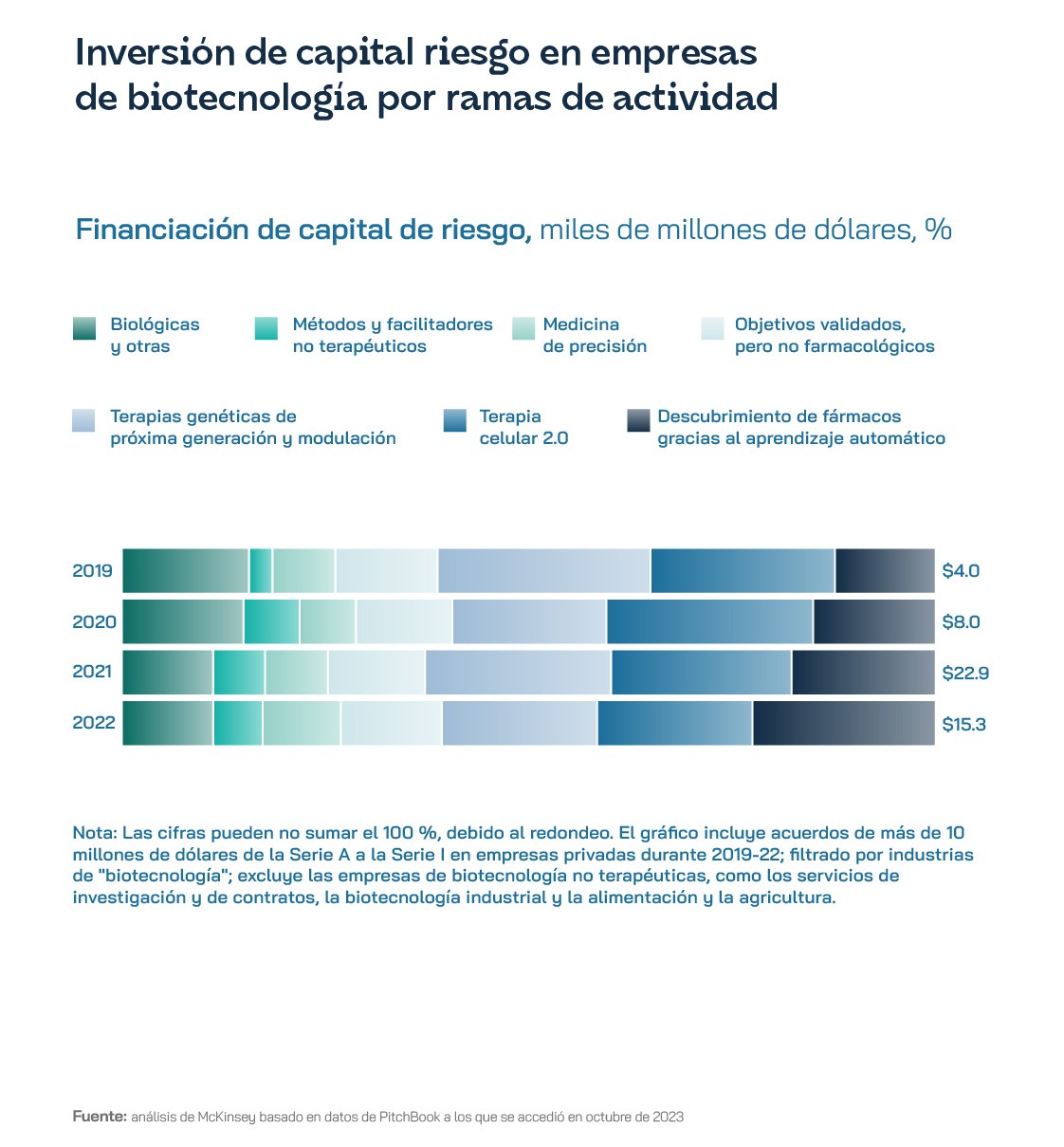
A estos condicionantes se añadió en 2023 una llamativa pérdida de interés de los inversores, tras el estallido asociado a la pandemia del COVID-19. El capital riesgo quiere ver rentabilidad en el horizonte y eso empuja a las empresas biotecnológicas a dedicar su atención a los ensayos clínicos para lanzar nuevos productos al mercado lo más rápido posible. Debido al alto precio que tienen éstos, varias empresas centradas en CRISPR han reducido plantillas, en un entorno de despidos generalizado que ha implicado a más de 250 firmas del sector entre 2022 y 2023. Han decidido enfocarse en sus productos más desarrollados, en lugar de abordar nuevos tratamientos y expandir en otras áreas de enfermedades. El S&P Biotechnology Select Industry Index cerró el cuarto trimestre de 2023 un 50% por debajo de su máximo de febrero de 2021. Ese año sólo 30 empresas biotecnológicas habían realizado una IPO (Initial Public Offering) en los primeros tres trimestres de 2023 frente a las 114 de 2021, y el capital captado ascendió a solo 3.400 millones de dólares, frente a 16.000 millones de dos años antes. Un indicador de mayor propensión al conservadurismo podría ser que, en el cuarto trimestre de ese año, el número de terapias génicas en ensayos clínicos de fase III creció un 10%, lo que supuso el primer aumento trimestral de ese tipo desde el tercer trimestre de 2022.
A principios de 2024, sólo estaba previsto un ensayo en una sola área de enfermedad nueva para todo el año: la autoinmunidad. Editas Medicine estaba realizando evaluaciones de fase 1/2 para personas con ECF grave y TDT, utilizando un sistema CRISPR con la proteína Cas12a, en lugar de la más famosa Cas9, en lo que suponía el primer caso de utilización de la Cas12 en un ensayo clínico. También en enero de 2024, Beam Therapeutics anunció que había dosificado al primer participante en su ensayo de fase 1/2 en EEUU de una terapia de edición de bases para la ECF grave. La edición bases es una versión de la tecnología CRISPR-Cas9 que cambia una sola letra del ADN, sin crear roturas en la doble hebra del ADN, lo que reduce ciertos riesgos, por lo que ha despertado interés entre los inversores. Hasta ese momento, todas las terapias eran ex vivo: las células se extraían del cuerpo, se editaban y se controlaba su calidad en un laboratorio especial, hasta que eran devueltas al cuerpo después de que el paciente se sometiera a una quimioterapia intensiva. La terapia in vivo significaría administrar el medicamento de edición genética directamente en el cuerpo de la persona, donde se editan las células.
A pesar del duro contexto, empresas como Scribe Therapeutics, en ingeniería CRISPR por diseño, Sail Biomedicines, en programación de ARN, y ADARx Pharmaceuticals, en edición de ARN, subrayaban la voluntad de la industria de apostar por tecnologías novedosas incluso cuando enfoques existentes como CRISPR-Cas9, CAR-T y TCR aún están en desarrollo. Una tendencia destacada es la creciente colaboración con nuevas empresas emergentes de fabricación y desarrollo de contratos, como ElevateBio y Resilience, para aprovechar su experiencia en fabricación especializada. Se investigan, asimismo, proteínas de fusión CRISPR y nuevas nucleasas por su capacidad para facilitar integraciones específicas en grandes secuencias genéticas, de modo que, en lugar de reparar mutaciones individuales, se puedan reemplazar completamente secuencias genómicas defectuosas más grandes con versiones corregidas, expandiendo potencialmente el impacto de la edición genética a más enfermedades.
La estrategia de la FDA norteamericana pasa por agilizar la aprobación de tecnologías de plataforma. La Ley Ómnibus de Asignaciones de 2023 contiene disposiciones para facilitar la aprobación de nuevas terapias genéticas. Una tecnología de plataforma se aplica cuando todas las partes de un tratamiento se estandarizan en un único paquete disponible en el mercado y solo ciertas partes cambian para una enfermedad determinada. Para los tratamientos basados en CRISPR, la parte estandarizada incluiría a la proteína Cas, el método de entrega a las células, la administración del tratamiento y la dosis que recibe el paciente. Lo único que cambiaría sería la secuencia del ARN guía y la plantilla de reparación de ADN que deba especificarse para diferentes ediciones. A principios de 2024, CRISPR Therapeutics se declaraba bien posicionada para ejecutar ensayos clínicos en áreas como oncología, autoinmunidad, cardiovascular y diabetes, con la perspectiva de obtener resultados durante los siguientes 12 a 18 meses, abierta a innovar en su plataforma de tecnologías de entrega y edición de genes de próxima generación, incluso en el entorno macroeconómico desafiante para las empresas de biotecnología.
En última instancia, la tecnología CRISPR estará asociada siempre a la batalla de las patentes. Desde que, en abril de 2014, la USPTO (United States Patent and Trademark Office) otorgó la patente estadounidense n.° 8.697.359 al Broad Institute, el MIT y el científico Feng Zhang, los componentes y métodos CRISPR recogidos en ella se han convertido en el estándar líder para la edición del genoma en todo el mundo. Los propietarios de la patente han compartido abiertamente reactivos y herramientas CRISPR con más de 3.000 instituciones en 75 países a través de la organización sin fines de lucro Addgene. Para la investigación de empresas, Broad Institute otorga licencias de CRISPR IP a través de un modelo abierto de “innovación inclusiva” que permite maximizar las oportunidades de desarrollo terapéutico en enfermedades humanas. Las patentes emitidas por Broad son para la edición del genoma y su uso en células eucariotas, incluidas células de animales, humanos y plantas. El instituto insiste en diferenciarlas, en consecuencia, de las que emite la Universidad de California-Berkeley (UCB), que no son específicas para usos en células eucariotas, y en pedir a ésta que se una a las discusiones sobre un grupo de patentes u otro enfoque de concesión de licencias coordinadas, como el que desarrolló para CRISPR en la agricultura. En Europa, al Broad Institute se le han concedido 33 patentes CRISPR, incluidas 29 patentes relacionadas con CRISPR-Cas9 y cuatro relacionadas con CRISPR-Cas12/Cpf1, pero tanto éstas como las aprobadas para la UCB han encontrado la oposición de múltiples partes, por lo general por cuestiones técnicas de la solicitud.
Ciencia básica pendiente de transferencia
Eventos internacionales como The CRISPR MEDiCINE Conference de Copenhague (Dinamarca) ponen de manifiesto el potencial de la ciencia básica española en el desarrollo de técnicas asociadas a la salud. Está muy por encima del nivel de desarrollo alcanzado por la industria hasta el momento para escalar estas soluciones.
Para la corrección aguda de una amplia gama de mutaciones asociadas a enfermedades se viene apostando por la edición genética. Pero en determinados casos, como la anemia de Fanconi (FA), el mecanismo de reparación del ADN dirigida por homólogos, el más convencional, no funciona y se requieren enfoques de terapia génica alternativos. CIEMAT/CIBERER de Madrid ha optimizado el uso de la edición de bases y la edición principal para corregir potencialmente la mayoría de las mutaciones descritas en pacientes, con el objetivo final de generar fármacos más personalizados. Asimismo, junto al Fundación Instituto de Investigación Sanitaria de la Fundación Jiménez Díaz, la Universidad Carlos III, IMDEA Nanociencia y el Hospital Ramón y Cajal, están investigando también en mecanismos para evitar los efectos de la queratodermia palmoplantar debilitante, asociada a ampollas angustiosas que limitan gravemente su capacidad para caminar, que suelen desarrollar los pacientes de paquioniquia congénita, un trastorno cutáneo hereditario poco común. Las herramientas CRISPR abren posibilidades para protocolos de terapia génica con los que hacer frente a esta dolencia.
Por otra parte, se ha demostrado que el uso de nickasas Cas9 emparejadas para la alteración genética in vivo proporciona una vía potencial para disminuir las frecuencias de inserción de virus adenoasociados. Sin embargo, esta técnica requiere más investigación para comprender los factores que influyen en la elección de las vías de reparación de rotura de doble hebra escalonada. Investigadores de la Universidad de Navarra y la Harvard Medical School, están profundizando en esa línea.
Centros españoles de Universitat de Barcelona, CIBERER, Instituto de Salud Carlos III (ISCIII), IBUB e IRSJD, trabajan junto a la Universidad de Lund (Suecia) en los trastornos del neurodesarrollo causados por diferentes perturbaciones durante el desarrollo temprano del cerebro. Muchos de ellos tienen un origen genético, pero la mayoría de las alteraciones genéticas subyacentes siguen siendo desconocidas. El desafío consistía en avanzar en el conocimiento de ese proceso dado el acceso limitado a los tejidos cerebrales humanos en los primeros momentos del desarrollo y a la dificultad de utilizar modelos animales. El proyecto ha utilizado modelos in vitro de vanguardia acoplados a técnicas de secuenciación y edición de genes de última generación para estudiar los efectos que tienen una serie de mutaciones. Entre otras acciones, se generaron líneas de células madre pluripotentes inducidas, editadas con CRISPR, que incorporaban dos de las mutaciones estudiadas y ello ha permitido alcanzar hallazgos de importancia crítica. Los mismos actores españoles han trabajado en otro un enfoque prometedor para aliviar el dolor basado en la inactivación de dos enzimas que modulan los niveles de endocannabinoides, sienta las bases para explorar el potencial terapéutico de la edición de genes con ese objetivo en el sistema nervioso periférico.
La conexión internacional de nuestro ecosistema de investigación ha permitido también a CIEMAT y UC3M, además del Hospital Universitario “12 de Octubre” de Madrid, trabajar con el University College Dublin y la Universidad de Ciencia y Tecnología de Anhui (Huainan, China) en una plataforma para el cáncer pulmonar que utiliza biomateriales sintéticos para la administración de reactivos CRISPR/Cas9 a células epiteliales de pulmón adultas. Ha demostrado ser un enfoque eficiente para modelar la tumorigénesis pulmonar al inactivar simultáneamente un conjunto de genes supresores de tumores.
En el ámbito de la transferencia de estos avances al mundo emprendedor, destacan compañías biotecnológicas como Integra Therapeutics, que está creando herramientas de escritura genética de próxima generación. Se basa en la tecnología FiCAT, obtenida a partir de la investigación del laboratorio del Dr. Marc Güell en la Universidad Pompeu Fabra y orientada a resolver las limitaciones actuales en la escritura genética: tamaño, precisión y estabilidad. A mediados de 2024, se anunció la concesión de una subvención de 2,5 millones de euros y una inversión de capital de hasta ocho millones de euros de la Comisión Europea en la compañía a través del programa Accelerator del Consejo Europeo de Innovación (EIC). Integra Therapeutics destinará los 2,5 millones de euros iniciales a las actividades de precomercialización de su plataforma FiCAT para la ingeniería de células T y células madre hematopoyéticas (HSC), para desarrollar terapias celulares en enfermedades raras, enfermedades autoinmunes y oncología.


